NOTA STAMPA
Presentati all’Alzheimer’s Association International Conference (AAIC) e pubblicati su JAMA i risultati dell’importante studio di fase III su donanemab di Lilly
Donanemab ha rallentato in modo significativo il declino cognitivo e funzionale nei pazienti con malattia di Alzheimer sintomatica precoce positiva per l’amiloide, riducendo il rischio di progressione; quasi la metà dei partecipanti trattati con donanemab nello stadio iniziale della malattia non hanno mostrato progressione clinica a 1 anno
Ulteriori analisi di sottopopolazione hanno dimostrato che i partecipanti allo studio con malattia in fase più precoce hanno avuto un beneficio ancora maggiore, con un rallentamento del declino del 60% rispetto al placebo
Inoltre, l’effetto del trattamento ha continuato ad aumentare rispetto al placebo nel corso dello studio, anche se molti partecipanti hanno completato il ciclo di terapia a 6 o 12 mesi, supportando una somministrazione di durata limitata
La sottomissione alla FDA è stata completata nel secondo trimestre, con esito atteso entro fine anno
Sesto Fiorentino (FI), 17 luglio 2023 – Eli Lilly ha presentato i risultati completi dello studio di fase III TRAILBLAZER-ALZ 2, i quali dimostrano che donanemab ha rallentato in modo significativo il declino cognitivo e funzionale nelle persone con malattia di Alzheimer (AD) sintomatica precoce. I dati sono stati condivisi in occasione dell’edizione 2023 dell’ Alzheimer’s Association International Conference (AAIC) nel corso di un simposio di primo piano, e sono stati pubblicati contemporaneamente sul Journal of the American Medical Association (JAMA).
“ I dati positivi di TRAILBLAZER-ALZ 2 danno speranza alle persone con malattia di Alzheimer, le quali hanno urgente bisogno di nuove opzioni terapeutiche. Questo è il primo studio di fase III in cui una terapia capace di modificarela progressione della malattia replica i risultati clinici positivi osservati in uno studio precedente”, ha affermato Huzur Devletsah, Presidente e Direttore Generale di Lilly Italy Hub. “ Se approvato, riteniamo che donanemab possa fornire alle persone con malattia di Alzheimer benefici clinicamente significativi, nonché la possibilità di completare il loro ciclo di trattamento già 6 mesi dopo che la placca amiloide è stata eliminata. Nell’ambito di un ecosistema sanitario già complesso per quanto riguarda il morbo di Alzheimer, dobbiamo continuare a rimuovere qualsiasi barriera di accesso alla diagnosi e terapia mirate all’amiloide”.
Lilly aveva precedentemente annunciato che, nel corso dello studio clinico di fase III, donanemab ha raggiunto l’endpoint primario e tutti gli endpoint secondari cognitivi e funzionali. La presentazione alla FDA statunitense per l’approvazione è stata completata lo scorso trimestre, con una decisione regolatoria prevista entro la fine dell’anno. Sono attualmente in corso le sottomissioni anche ad altre Autorità Regolatorie nel mondo, la maggior parte delle quali verrà completata entro la fine dell’anno.
I risultati di TRAILBLAZER-ALZ 2 supportano la domanda di Lilly per l’approvazione regolatoria per il trattamento di persone con malattia di Alzheimer sintomatica precoce positiva per l’amiloide (deterioramento cognitivo lieve o demenza lieve), a prescindere dal loro livello basale di tau. TRAILBLAZER-ALZ 2 ha arruolato partecipanti con più ampi punteggi cognitivi e livelli di amiloide rispetto ad altri recenti studi sulle terapie mirate alla placca amiloide. I partecipanti a TRAILBLAZER-ALZ 2 sono stati stratificati in base al loro livello di tau, un biomarcatore predittivo per la progressione della malattia, in un braccio tau medio-basso (a volte indicato come tau intermedio) o in un braccio tau alto, che rappresentava uno stadio patologico successivo di progressione della malattia. Tutti i partecipanti sono stati quindi valutati nell’arco di 18 mesi, utilizzando scale che misurano sia la capacità cognitiva che quella funzionale, tra cui l’ Alzheimer’s Disease Rating Scale integrata (iADRS) e il Clinical Dementia Rating-Sum of Boxes (CDR-SB).
Come riportato in precedenza, tra i partecipanti con livelli medio-bassi di tau (n=1182), il trattamento con donanemab ha rallentato in modo significativo il declino, con un risultato del 35% secondo la scala iADRS e del 36% secondo il CDR-SB. Tra tutti i partecipanti allo studio sull’AD sintomatica precoce positiva all’amiloide (n=1736), il trattamento con donanemab ha rallentato in modo significativo il declino del 22% secondo l’ iADRS e del 29% secondo il CDR-SB. Ulteriori dati presentati all’AAIC hanno rafforzato il fatto che, a prescindere dallo stadio clinico o patologico della malattia al basale, il trattamento con donanemab ha prodotto benefici cognitivi e funzionali rispetto al placebo:
Un’analisi pre-specificata di sottopopolazione tra i partecipanti con tau medio-bassa basata sullo stadio clinico ha dimostrato un maggior beneficio di donanemab nei soggetti in uno stadio iniziale della malattia:
- Nei partecipanti con decadimento cognitivo lieve (n=214), donanemab ha rallentato il declino del 60% secondo iADRS e del 46% secondo CDR-SB
- Per i partecipanti con demenza lieve dovuta ad AD, n=534, donanemab ha rallentato il declino del 30% secondo iADRS e del 38% secondo CDR-SB).
Allo stesso modo, un’analisi di sottogruppo post-hoc tra i partecipanti con tau medio-bassa basata sull’età, ha dimostrato un maggiore beneficio di donanemab nei pazienti di età inferiore ai 75 anni:
- Nei partecipanti di età inferiore ai 75 anni (n=267), donanemab ha rallentato il declino del 48% secondo iADRS e del 45% secondo CDR-SB.
- Nei partecipanti di età pari o superiore a 75 anni (n=266), donanemab ha rallentato il declino del 25% secondo iADRS e del 29% secondo CDR-SB.
I risultati erano simili tra i vari sottogruppi, compresi i partecipanti portatori o meno di un allele ApoE4.
L’effetto complessivo del trattamento con donanemab ha continuato a crescere durante tutto lo studio, con le maggiori differenze rispetto al placebo osservate a 18 mesi.
“Questi risultati dimostrano che diagnosticare e trattare le persone più precocemente nel corso della malattia di Alzheimer può portare a un beneficio clinico rilevante”, ha affermato Alessandro Padovani, Presidente della Società Italiana di Neurologia e Direttore dell’Istituto di Neurologia Clinica presso il Dipartimento di Continuità di Cura e Fragilità, AOU Spedali Civili di Brescia. “Il ritardo nella progressione della malattia nel corso della sperimentazione è significativo e può dare alle persone più tempo per fare le cose che sono significative per loro. Le persone che vivono con la malattia di Alzheimer precoce e sintomatica continuano a lavorare, a godersi i viaggi, a condividere tempo di qualità con la famiglia: vogliono sentirsi se stessi, più a lungo. I risultati di questo studio rafforzano la necessità di diagnosticare e trattare la malattia prima di quanto si faccia oggi.”.
Donanemab agisce in modo specifico sulla placca amiloide depositata e ha dimostrato di portare alla sua rimozione nei pazienti trattati. Il trattamento con donanemab ha ridotto in modo significativo i livelli di placca amiloide, a prescindere dallo stadio patologico della malattia al basale. Tra tutti i partecipanti, il trattamento con donanemab ha ridotto la placca amiloide in media dell’84% a 18 mesi, rispetto a una diminuzione dell’1% per i partecipanti con placebo. Una volta soddisfatti i criteri predefiniti di clearance della placca amiloide, i partecipanti hanno potuto interrompere l’assunzione di donanemab.* Circa la metà dei partecipanti ha raggiunto questa soglia a 12 mesi, e circa sette partecipanti su dieci l’hanno raggiunta a 18 mesi.
Nella fase patologica iniziale della malattia nei partecipanti con tau medio-bassa, il trattamento con donanemab ha prodotto assenza di progressione a un anno nel 47% dei partecipanti secondo la valutazione CDR-SB, rispetto al 29% con placebo. I partecipanti trattati con donanemab hanno anche presentato un rischio inferiore (39%) di progredire allo stadio clinico successivo della malattia nel corso dello studio di 18 mesi. Questo ritardo nella progressione ha significato che, in media, i partecipanti trattati con donanemab hanno avuto altri 7,5 mesi prima di raggiungere lo stesso livello di declino cognitivo e funzionale secondo CDR-SB rispetto a quelli con placebo.
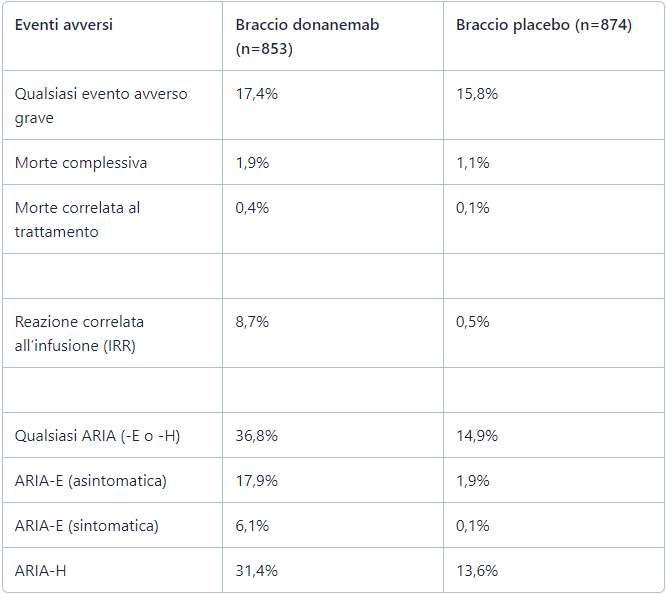
L’incidenza di anomalie all’imaging correlate all’amiloide (ARIA, amyloid-related imaging abnormalities) e delle reazioni correlate all’infusione è stata coerente con il precedente studio TRAILBLAZER-ALZ. Si verificano casi di ARIA in tutta la classe delle terapie anticorpali volte a eliminare la placca amiloide. Sono più comunemente osservate come gonfiore temporaneo in una o più aree del cervello (ARIA-E) o come micro-emorragie o siderosi superficiale (ARIA-H) – in entrambi i casi rilevate da risonanza magnetica – le quali possono essere gravi e, in alcuni casi, persino fatali. Questo rischio deve essere gestito mediante attenta osservazione, monitoraggio con risonanza magnetica e azioni appropriate, se vengono rilevate ARIA. Sono state osservate anche gravi reazioni correlate all’infusione, nonché anafilassi.
Per i risultati completi di TRAILBLAZER-ALZ 2, consultare la pubblicazione su JAMA.
Lo studio TRAILBLAZER-ALZ 2 e il programma TRAILBLAZER-ALZ
TRAILBLAZER-ALZ 2 (NCT04437511) è uno studio di fase III, in doppio cieco, controllato con placebo, condotto per valutare la sicurezza e l’efficacia di donanemab in partecipanti di età compresa tra 60 e 85 anni con malattia di Alzheimer sintomatica precoce (decadimento cognitivo lieve, MCI, o demenza lieve dovuta alla malattia di Alzheimer) con presenza confermata di neuropatologia da malattia di Alzheimer. Lo studio ha arruolato 1736 partecipanti in 8 paesi, selezionati sulla base di valutazioni cognitive in combinazione con l’imaging della placca amiloide e la stadiazione della tau mediante imaging PET.
Nel 2021 Lilly aveva già annunciato e pubblicato sul New England Journal of Medicine (NEJM) i risultati dello studio di fase II TRAILBLAZER-ALZ. Inoltre, nel 2022 Lilly ha condiviso i dati di TRAILBLAZER-ALZ 4 – il primo studio di confronto attivo nella malattia di Alzheimer sintomatica precoce – in occasione della 15a conferenza sugli studi clinici sulla malattia di Alzheimer (CTAD, Clinical Trials on Alzheimer's Disease).
Lilly continua a studiare donanemab in diversi studi clinici, ivi incluso TRAILBLAZER-ALZ 3, che si concentra sulla prevenzione della malattia di Alzheimer sintomatica nei partecipanti con AD preclinica; TRAILBLAZER-ALZ 5, uno studio registrativo sulla malattia di Alzheimer sintomatica precoce attualmente in corso di arruolamento in Cina; e TRAILBLAZER-ALZ 6, che si concentra sull’espansione della nostra comprensione delle ARIA attraverso nuove sequenze alla RM, biomarcatori basati sul sangue e diversi regimi di dosaggio di donanemab.
Lilly
Lilly è un’azienda leader a livello globale nel settore sanitario, capace di coniugare la cura dei pazienti con la ricerca al fine di migliorare la vita delle persone di tutto il mondo. Fondata oltre un secolo fa da un uomo determinato a realizzare farmaci di alta qualità che rispondessero a esigenze reali, l’azienda rimane ancora oggi fedele a questa mission in ogni sua attività. In tutto il mondo, il personale di Lilly lavora per scoprire e mettere a disposizione delle persone che ne hanno bisogno, farmaci in grado di cambiare la loro vita, per ampliare le conoscenze e migliorare la gestione delle malattie, e per contribuire al benessere delle comunità attraverso attività filantropiche e di volontariato. Per ulteriori informazioni su Lilly, consultare i siti www.lilly.it
* I partecipanti hanno completato il ciclo di trattamento con donanemab una volta raggiunto un livello predefinito di clearance della placca (<24,1 centiloidi). I livelli medi di amiloide al basale per i partecipanti con malattia di Alzheimer sintomatica precoce erano di circa 100 centiloidi.
Per maggiori informazioni:
Lilly
Raffaella Bugliazzini, Responsabile Comunicazione e Relazioni con i Media
+39 342 7490362 (cellulare)
Benedetta Bitozzi, Associate Director – Communication Advocacy & Policy
+39 3358727340 (cellulare)